La luz es una radiación que corresponde a un pequeño intervalo dentro del espectro electromagnético (Fig 3.32).
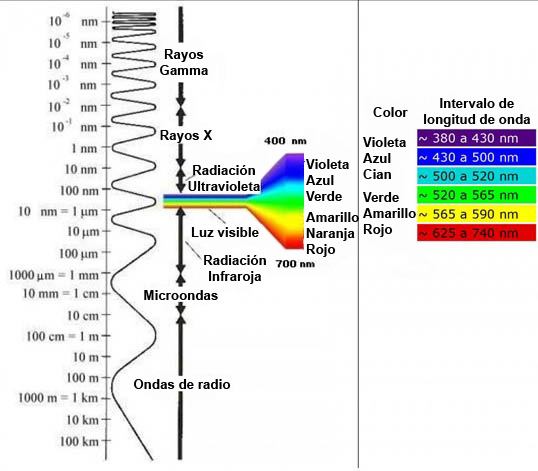
Fig 3.32 Espectro electromagnético y el intervalo donde se localiza la luz visible, con indicación de las longitudes de onda asociadas a cada tipo de radiación.
En una reacción química una o más moléculas o especies químicas se transforman en otras. Para que esta reacción tenga lugar se debe suministrar energía de activación, habitualmente en forma de calor. En las reacciones fotoquímicas es la luz la que proporciona la energía de activación.
Una reacción fotoquímica puede tener lugar cuando una molécula que se encuentra en su estado fundamental es irradiada con luz de una frecuencia correspondiente a la diferencia de energía entre el estado fundamental y el sido excitado, de forma que puede absorber un quantum de energía llumínica, lo cual produce una transición electrónica que hace que la molécula pase a un estado de mayor energía o estado excitado.
S + hγ → S*
El diagrama de Jablonski (Fig 3.33) permite visualizar los procesos de una molécula asociados a la irradiación con luz: absorción fotónica y excitación del estado fundamental (S) a un nivel energético electrónico, vibracional o rotacional superior (S*), y recuperación del estado fundamental S0 a través de diferentes estados electrónicos singlete S1 y/o triplete T1, con emisión de fluorescencia o fosforescencia.
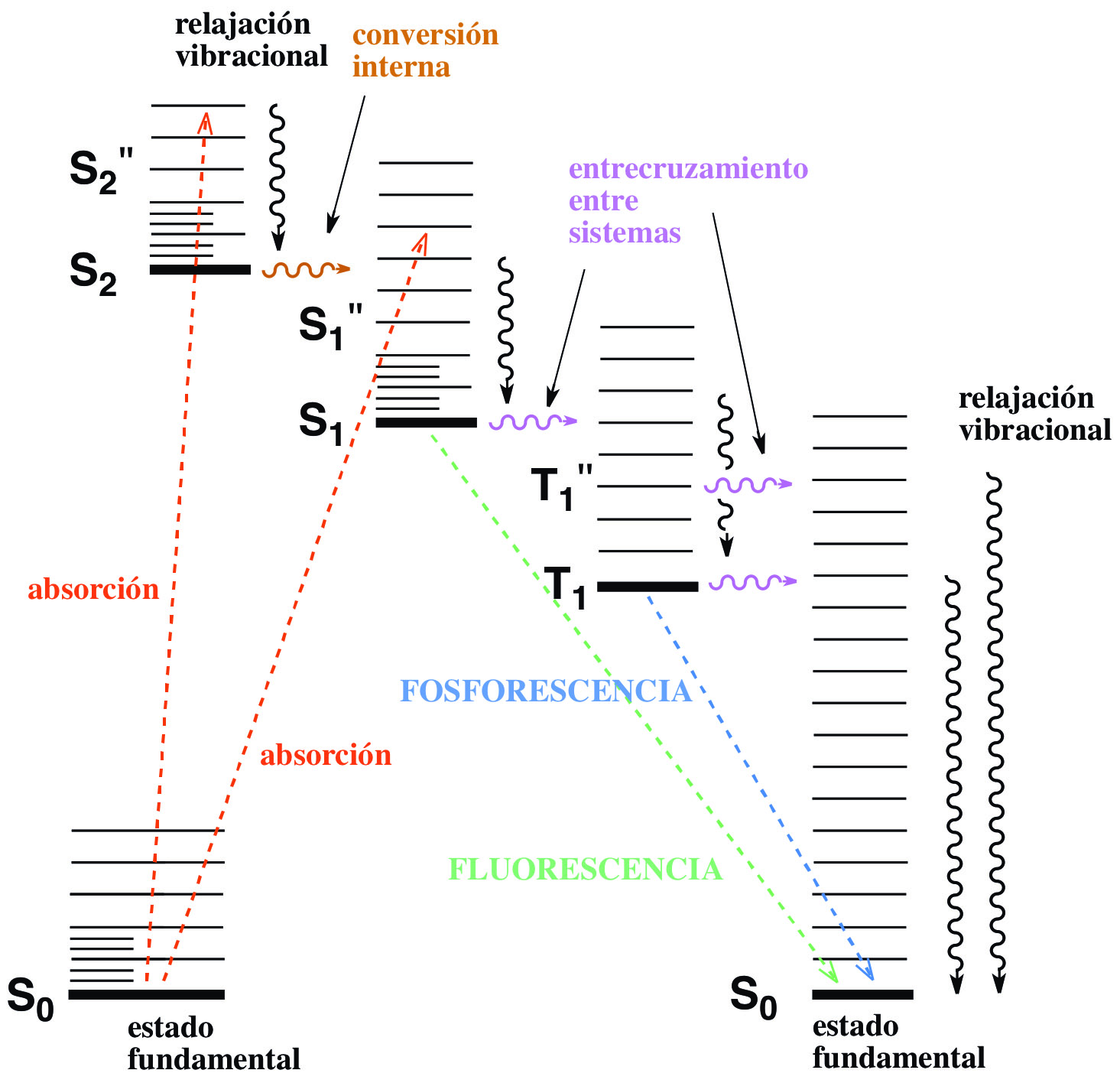
Fig 3.33 Diagrama de Jablonski.
El retorno al estado fundamental puede ir acompañado de una transformación química de la molécula. Los procesos fotoquímicos primarios más frecuentes son: a) disociación en radicales, que puede iniciar una reacción en cadena, b) disociación en iones, c) ionización, d) activación y e) reorganización intramolecular. También pueden tener lugar procesos fotoquímicos secundarios que estan relacionados con la transferencia de energía a una segunda molécula presente en el medio.
Este tipo de reacciones se diferencian claramente de las reacciones tradicionales en que:
- Dado que los estados excitados son ricos en energía son posibles reacciones altamente endotérmicas en el estado fundamental.
- Los orbitales antienlazantes se encuentran ocupados en el estado excitado, lo cual puede permitir reacciones que no tendrían lugar en el estado fundamental por razones electrónicas.
- Mientras las reacciones térmicas sólo implican estados singulete, las reacciones fotoquímicas pueden incluir estados singulete y triplete, y por lo tanto, se pueden generar intermedios de reacción que no son accesibles bajo condiciones térmicas.
Como consecuencia, las reacciones fotoquímicas se convierten en una potente herramienta sintética para lograr productos no accesibles por métodos sintéticos convencionales. La absorción de un fotón de luz por una molécula reactiva puede permitir que una reacción sea posible no sólo proporcionando la energía de activación, sino también cambiando la simetría de la configuración electrónica de la molécula, lo cual permite mecanismos de reacción inaccesibles, según describen las reglas de Woodward-Hoffman. Por ejemplo, una reacción de cicloaddición es un ejemplo de reacción pericíclica que puede ser analizada según estas normas o la teoría del orbital molecular.
Leyes fundamentales:
- Ley de Grotthus-Draper: la luz debe ser absorbida por una sustancia química para que se dé una reacción fotoquímica.
- Ley de Stark-Einstein: cada fotón absorbido por un sistema químico sólo activa una molécula para dar una reacción fotoquímica. Este principio se conoce también como la ley de la fotoequivalencia. De esta ley deriva el cálculo del rendimiento cuántico de la reacción, que se define como el cociente de moléculas que han reaccionado y el número de fotones absorbidos en la reacción.
Aplicación:
La aplicación más desarrollada de la fotoquímica hasta el momento es la síntesis orgánica, pero sus aplicaciones se extienden a la conversión y almacenamiento de energía, como elemento que controla la funcionalidad de interruptores y máquinas moleculares y de sensores fotoactivos, así como aplicaciones médicas como la terapia fotodinàmica.



