La llum és una radiació que correspon a un petit interval dins l’espectre electromagnètic (Fig 3.32).
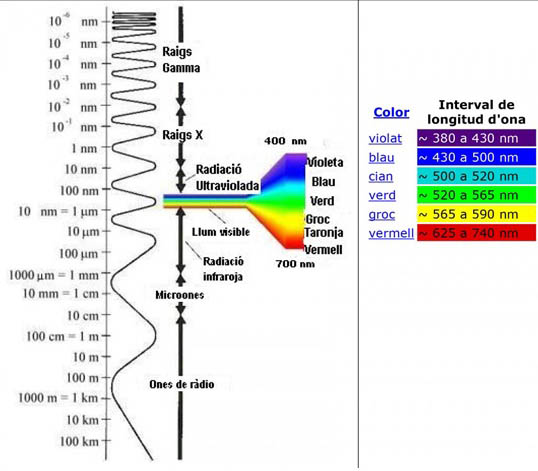
Fig 3.32 Espectre electromagnètic i l’interval on es localitza la llum visible, amb indicació de les longituds d’ona associades a cada tipus de radiació.
En una reacció química una o més molècules o espècies químiques es transformen en d’altres. Per tal que aquesta reacció tingui lloc cal subministrar energia d’activació, habitualment en forma de calor. En les reaccions fotoquímiques és la llum la que proporciona l’energia d’activació.
Una reacció fotoquímica pot tenir lloc quan una molècula que es troba al seu estat fonamental és irradiada amb llum d’una freqüència corresponent a la diferència d’energia entre l’estat fonamental i l’estat excitat, de manera que pot absorbir un quantum d’energia llumínica, la qual cosa produeix una transició electrònica que fa que la molècula passi a un estat de major energia o estat excitat.
S + hγ → S*
El diagrama de Jablonski (Fig 3.33) permet visualitzar els processos associats a la irradiació amb llum d’una molècula: absorció fotònica i excitació de l’estat fonamental (S) a un nivell energètic electrònic, vibracional o rotacional superior (S*), i recuperació de l'estat fonamental S0 a través de diferents estats electrònics singlet S1 i/o triplet T1, amb emissió de fluorescència o fosforescència.
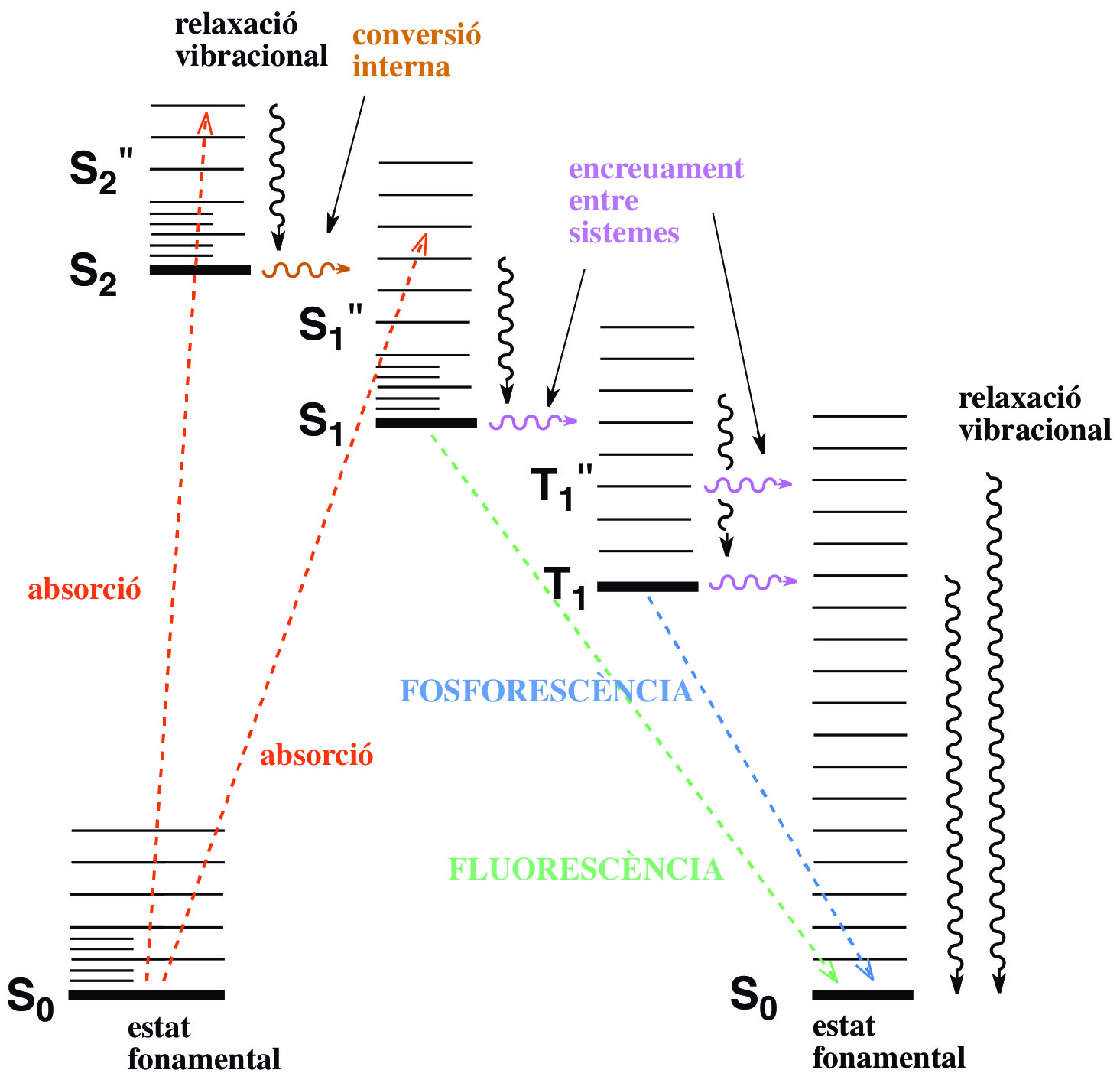
Fig 3.33 Diagrama de Jablonski.
La tornada a l’estat fonamental pot anar acompanyada d’una transformació química de la molècula. Els processos fotoquímics primaris més freqüents són: a) dissociació en radicals, que pot iniciar una reacció en cadena, b) dissociació en ions, c) ionització, d) activació i e) reorganització intramolecular. També poden tenir lloc processos fotoquímics secundaris que tenen a veure amb la transferència d’energia a una segona molècula present en el medi.
Aquest tipus de reaccions es diferencien clarament de les reaccions tradicionals en que:
a) Donat que els estats excitats són rics en energia són possibles reaccions altament endotèrmiques a l’estat fonamental.
b) Els orbitals antienllaçants es troben ocupats a l’estat excitat, la qual cosa pot permetre reaccions que no tindrien lloc a l’estat fonamental per raons electròniques.
c) Mentre les reaccions tèrmiques només impliquen estats singlet, les reaccions fotoquímiques poden incloure estats singlet i triplet, i per tant, es poden generar intermedis de reacció que no són accessibles sota condicions tèrmiques.
Com a conseqüència, les reaccions fotoquímiques esdevenen una potent eina sintètica per assolir productes no accessibles per mètodes sintètics convencionals. L’absorció d’un fotó de llum per una molècula reactiva pot permetre que una reacció sigui possible no només proporcionant l’energia d’activació, sinó també canviant la simetria de la configuració electrònica de la molècula, la qual cosa permet mecanismes de reacció altrament inaccessibles, segons descriuen les regles de Woodward-Hoffman. Per exemple, una reacció de cicloaddició és un exemple de reacció pericíclica que pot ser analitzada d’acord a aquestes normes o la teoria de l’orbital molecular.
Lleis fonamentals:
1.- Llei de Grotthus-Draper: la llum ha de ser absorbida per una substància química per tal que es doni una reacció fotoquímica.
2.- Llei de Stark-Einstein: cada fotó absorbit per un sistema químic només activa una molècula per a donar una reacció fotoquímica. Aquest principi es coneix també com la llei de la fotoequivalència. D’aquesta llei en deriva el càlcul del rendiment quàntic de la reacció, que es defineix com el quocient de molècules que han reaccionat i el nombre de fotons absorbits en la reacció.
Aplicació:
L’aplicació més desenvolupada de la fotoquímica fins el moment és la síntesi orgànica, però les seves aplicacions s’estenen a la conversió i emmagatzematge d’energia, com a element que controla la funcionalitat d’interruptors i màquines moleculars i de sensors fotoactius, així com aplicacions mèdiques com la teràpia fotodinàmica.



