MR (RECEPTOR DE MINERALOCORTICOIDES)
RECEPTORES NUCLEARES
El receptor de mineralocorticoides (MR) está codificado por el gen NR3C2 y pertenece a la subfamilia de receptores de hormonas esteroideas, junto con los receptores de estrógenos (ERs), andrógenos (ARs), progesterona (PRs) y glucocorticoides (GRs) Grossmann et al.
Ligandos
Los ligandos naturales de MR son los mineralocorticoides y los glucocorticoides, dos tipos de hormonas esteroideas sintetizadas en la corteza suprarrenal y que por su lugar de origen se conocen conjuntamente se conocen como corticosteroides. El principal mineralocorticoide es la aldosterona. El principal glucocorticoide en humanos es el cortisol. Dado que los glucocorticoides circulan a una concentración entre dos y tres órdenes de magnitud superior a la aldosterona, la activación específica de MR por mineralocorticoides depende de la co-expresión en determinadas células de una enzima, 11-b-hidroxiesteroide deshidrogenasa tipo 2 (11bHSD2), que metaboliza el cortisol produciendo cortisona, que es biológicamente inactiva. Gomez-Sanchez et al. Hellal-Levy et al.
Clasificación
MR es un receptor endocrino que forman parte de la subfamilia NR3 de la superfamilia de receptores nucleares (NRs). Previamente a su identificación molecular y debido a su afinidad por glucocorticoides, más elevada que la del propio receptor GR, se denominó receptor tipo II, siendo GR denominado receptor tipo I.
Estructura e interacciones
Todos los miembros de la familia de receptores nucleares comparten una estructura general organizada en dominios proteicos bien definidos. MR tienen una organización muy similar a otros receptores de hormonas esteroideas, distinguiéndose los siguientes dominios (Grossmann et al.):
- Dominio A/B (N-terminal domain, NTD): región N-terminal de la proteína que permite la unión a coactivadores transcripcionales, definiendo una zona con función de transactivación (AF-1), que en el caso de MR, al igual que en el de los receptores de progesterona y andrógenos, parece estar formada por dos regiones distintas del dominio (AF-1a y AF-1b); entre AF-1a y AF-1b se ha propuesto la existencia de una zona con actividad intrínseca de inhibición de la transcripción.
- Dominio C (DNA binding domain, DBD): región de unión al DNA altamente conservada, con dos motivos estructurales denominados “dedos de zinc” que definen la unión del receptor a los elementos de respuesta hormonal específicos (motivos HREs, comunes a GR, PR y AR), y participan en la dimerización del receptor.
- Dominio D (región bisagra; hinge domain, H): región de unión de los dominios C y E, y que da flexibilidad al receptor.
- Dominio E/F (ligand binding domain, LBD): región en posición C-terminal que permite la unión específica al ligando y la interacción con co-reguladores transcripcionales (función de transactivación AF-2 dependiente de ligando).
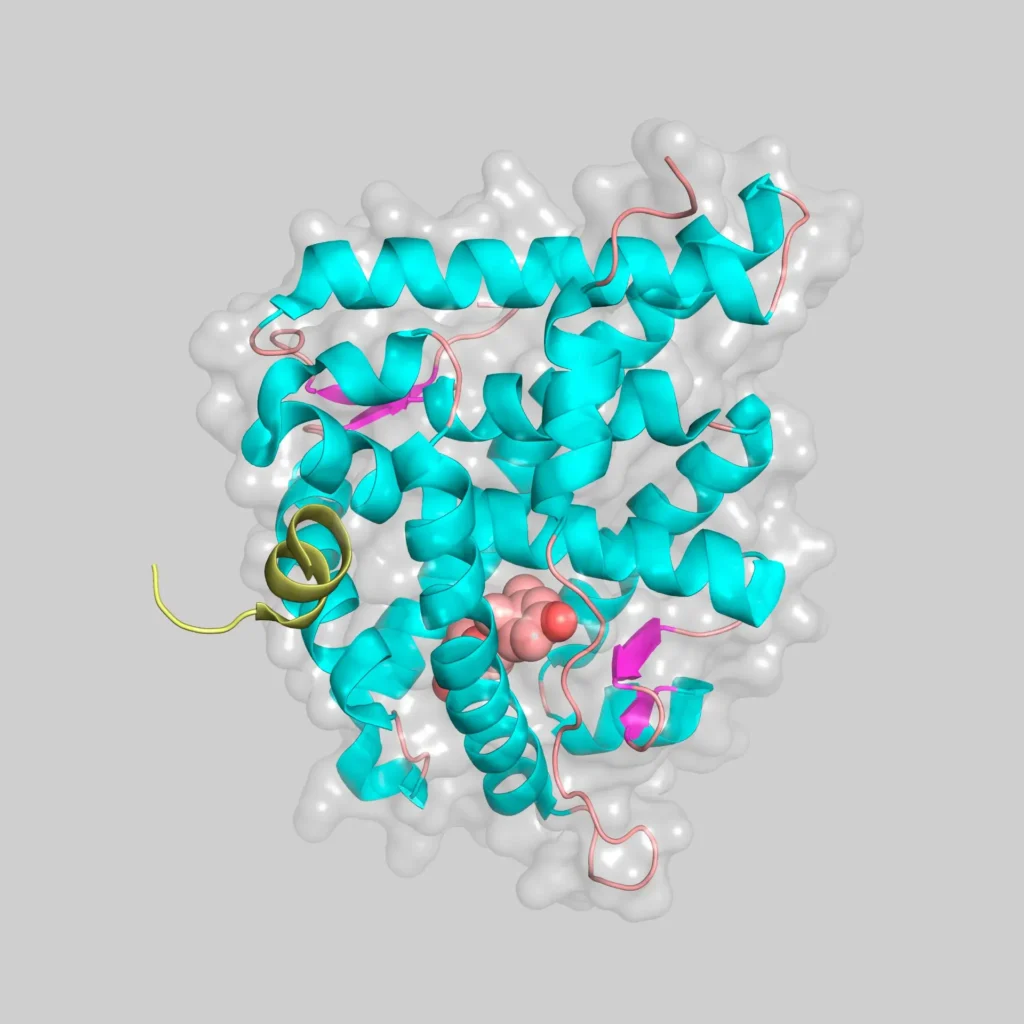
Estructura del MR
La estructura tridimensional de la proteína completa de MR no se conoce, debido principalmente al carácter intrínsecamente desordenado del dominio NTD, si bien disponemos de las estructuras del dominio DBD unido a DNA y del dominio LBD unido a distintos agonistas y antagonistas. (Grossmann et al.)
En ausencia de ligando, MR tiene localización citoplasmática, encontrándose unido a complejos proteicos de proteínas chaperonas de la familia HSP (heat-shock proteins) e inmunofilinas. Tras la unión del ligando, MR cambia de conformación, exponiendo señales que determinan su migración al núcleo y dimerización, posibilitan su interacción con la cromatina, reclutamiento de co-reguladores transcripcionales y, por tanto, regulación de la transcripción génica (Grossmann et al). También se ha propuesto la existencia de mecanismos de activación independientes de hormona (Shibata et al.)
Dado que la secuencia consenso HRE de unión a DNA (AGAACAnnnTGTTCT) es común a otros receptores como GR, PR y AR, la especificidad de acción de MR se ha explicado mediante el reclutamiento selectivo de co-reguladores transcripcionales (Grossmann et al.) o bien por la unión de otros factores de transcripción a elementos de respuesta adyacentes (van Weert et al.). Además de la unión a la secuencia consenso HRE, se ha propuesto que MR podría regular la transcripción génica indirectamente a través de interacción física con GR (mecanismo de amarre o tethering; Rivers et al.).
Recientemente se ha propuesto que los receptores de la familia NR3C pueden adoptar estructuras cuaternarias de orden superior al dímero (Presman et al.). Concretamente, MR se diferencia de GR, el receptor evolutivamente más cercano, en la formación de oligómeros de gran tamaño tras la unión a agonistas y HREs, si bien esta diferencia no impide la formación de heterómeros entre ambos receptores (Fettweis et al.). La interacción MR-GR parece alterar las respuestas transcripcionales de ambos receptores de forma específica para el ligando y tipo celular (Carceller et al.; Johnson et al.)
MR también participan en la iniciación de mecanismos de señalización no genómicos en respuesta a la unión de corticosteroides, principalmente activando rutas dependientes del receptor de crecimiento epidérmico (EGFR). Grossmann et al.
Expresión
MR tiene una expresión relativamente generalizada, si bien de baja abundancia. Los tipos celulares con expresión más prominente de MR son las células principales de los túbulos distal y colector renal, el epitelio del colon y las neuronas del hipocampo (Gomez-Sanchez et al.) La expresión de NR3C2 depende de dos promotores independientes que generan dos transcritos con regiones 5’ no traducidas diferentes. Si bien la proteína resultante posee características idénticas, estos transcritos tienen distinta estabilidad e importancia relativa durente el desarrollo y el envejecimiento (Gomez-Sanchez et al. Ibarrola et al.).
Principales funciones
Las funciones de MR dependen del tipo celular donde se expresa y del ligando que activa al receptor (Gomez-Sanchez et al.). La función fisiológica más conocida es la del mantenimiento del balance de agua y electrolitos en el organismo mediante la regulación del transporte iónico transepitelial en el riñón. Alteraciones en este proceso pueden producir hipertensión, alteraciones en el equilibrio ácido-base y en la excitabilidad celular. En el sistema nervioso, MR está implicado en la regulación de la ingesta de sal y agua, en la regulación del sistema nervioso simpático y, en estrecha colaboración con GR, en la respuesta al estrés. La activación inapropiada de MR tiene efectos nocivos sobre funciones cardiovasculares y metabólicas, promoviendo inflamación y fibrosis. Esto hace que MR sea una diana farmacológica de importancia creciente, con nuevas indicaciones terapéuticas en el tratamiento de insuficiencia renal y enfermedad renal crónica, particularmente en pacientes con diabetes (Kintscher et al.)
Los ARs en la Red NuRCaMeIn
- Fisiopatología del receptor de mineralorticoides | Universidad de La Laguna
- Receptores de corticosteroides (GR, MR) y biología de la piel | Instituto de Biomedicina de Valencia IBV-CSIC
- Estructura molecular de los receptores nucleares | Universitat de Barcelona.
Bibliografía
- Grossmann C, Almeida-Prieto B, Nolze A, Alvarez de la Rosa D. Structural and molecular determinants of mineralocorticoid receptor signalling. Br J Pharmacol. 2022 Jul;179(13):3103-3118. doi: 10.1111/bph.15746. Epub 2021 Dec 12. PMID: 34811739
- Gomez-Sanchez E, Gomez-Sanchez CE. The multifaceted mineralocorticoid receptor. Compr Physiol. 2014 Jul;4(3):965-94. doi: 10.1002/cphy.c130044. PMID: 24944027
- Hellal-Levy C, B Couette, J Fagart, A Souque, C Gomez-Sanchez, M Rafestin-Oblin. Specific hydroxylations determine selective corticosteroid recognition by human glucocorticoid and mineralocorticoid receptors. FEBS Lett. 1999 Dec 24;464(1-2):9-13. doi: 10.1016/s0014-5793(99)01667-1. PMID: 10611474
- Shibata S, Nagase M, Yoshida S, Kawarazaki W, Kurihara H, Tanaka H, Miyoshi J, Takai Y, Fujita T. Modification of mineralocorticoid receptor function by Rac1 GTPase: implication in proteinuric kidney disease. Nat Med. 2008 Dec;14(12):1370-6. doi: 10.1038/nm.1879. Epub 2008 Nov 23. PMID: 19029984
- Rivers CA, Rogers MF, Stubbs FE, Conway-Campbell BL, Lightman SL, Pooley JR. Glucocorticoid Receptor-Tethered Mineralocorticoid Receptors Increase Glucocorticoid-Induced Transcriptional Responses. Endocrinology. 2019 May 1;160(5):1044-1056. doi: 10.1210/en.2018-00819. PMID: 30980716
- van Weert LTCM, Buurstede JC, Mahfouz A, Braakhuis PSM, Polman JAE, Sips HCM, Roozendaal B, Balog J, de Kloet ER, Datson NA, Meijer OC. NeuroD Factors Discriminate Mineralocorticoid From Glucocorticoid Receptor DNA Binding in the Male Rat Brain. Endocrinology. 2017 May 1;158(5):1511-1522. doi: 10.1210/en.2016-1422. PMID: 28324065
- Presman DM, Ganguly S, Schiltz RL, Johnson TA, Karpova TS, Hager GL. DNA binding triggers tetramerization of the glucocorticoid receptor in live cells. Proc Natl Acad Sci U S A. 2016 Jul 19;113(29):8236-41. doi: 10.1073/pnas.1606774113. Epub 2016 Jul 5. PMID: 27382178
- Fettweis G, Johnson TA, Almeida-Prieto B, Presman DM, Hager GL, de la Rosa DA. The mineralocorticoid receptor forms higher order oligomers upon DNA binding. bioRxiv. 2023 Jun 14:2023.01.26.525752. doi: 10.1101/2023.01.26.525752. Preprint. PMID: 36789424
- Carceller-Zazo E, Sevilla LM, et al., The mineralocorticoid receptor modulates timing and location of genomic binding by glucocorticoid receptor in response to synthetic glucocorticoids in keratinocytes FASEB J. 2023 Jan;37(1):e22709. PMID: 36527388
- Johnson TA, Fettweis G, Wagh K, Almeida-Prieto B, Krishnamurthy M, Upadhyaya A, Hager GL, Alvarez de la Rosa D. The Glucocorticoid Receptor is Required for Efficient Aldosterone-Induced Transcription by the Mineralocorticoid Receptor. bioRxiv. 2023 Jun 17:2023.01.26.525745. doi: 10.1101/2023.01.26.525745. Preprint. PMID: 36789429
- Ibarrola J, Lu Q, Zennaro MC, Jaffe IZ. Mechanism by Which Inflammation and Oxidative Stress Induce Mineralocorticoid Receptor Gene Expression in Aging Vascular Smooth Muscle Cells. Hypertension. 2023 Jan;80(1):111-124. doi: 10.1161/HYPERTENSIONAHA.122.19213. Epub 2022 Nov 7. PMID: 36337050
- Kintscher U, Bakris GL, Kolkhof P. Novel non-steroidal mineralocorticoid receptor antagonists in cardiorenal disease. Br J Pharmacol. 2022 Jul;179(13):3220-3234. doi: 10.1111/bph.15747. Epub 2022 Jan 13. PMID: 34811750
