ER (RECEPTOR DE ESTRÓGENOS)
RECEPTORES NUCLEARES
Los receptores de estrógenos (ERs), tienen una alta afinidad por estrógenos y actúan regulando la expresión génica a través de varios mecanismos. Por su mecanismo clásico en el núcleo, regulando la transcripción después de unirse a los elementos de respuesta a estrógenos en el DNA.
También pueden regular la transcripción actuando dentro del núcleo, pero de manera no clásica, interaccionando con otros factores de transcripción como AP-1 o Sp-1.
Por último, pueden señalizar fuera del núcleo, activando cascadas de señalización que incluyen MAPKs, Src y Akt. La activación de estas vías de señalización puede finalizar en la regulación de la transcripción o en la regulación no transcripcional de enzimas, canales iónicos u otras proteínas involucradas en la función celular.
Los mamíferos presentan dos subtipos de receptor de estrógenos: ER alfa (ERα, también conocido como ESR1) y ER beta (ERβ o ESR2). Existe un tercer tipo de receptor de estrógenos, llamado “G-protein coupled estrogen receptor” (GPER), pero su estructura es la de un receptor acoplado a proteínas G.
Ligandos
Los ligandos principales de los ERs son los estrógenos (hormonas esteroideas), si bien ERα tiene una mayor afinidad por la estrona y ERβ por el estriol. No obstante, cabe destacar que son receptores promiscuos que unen compuestos exógenos, denominados estrógenos ambientales, que con frecuencia actúan como disruptores endocrinos.
Clasificación
Los ERs son miembros de la subfamilia NR3 de la gran superfamilia de receptores nucleares (NRs).
A su vez, en base a su afinidad por el ligando y a su modo de acción, se clasifican como receptores «endocrinos» y de Tipo I.
Estructura e interacciones
Todos los miembros de la familia de receptores nucleares comparten una estructura general multidominio. Los ERs están constituidos por los siguientes seis dominios:
- A/B (NTD / AF-1): dominio de unión a coactivadores con función de transactivación del DNA (AF-1), en posición N-terminal. Importante para la regulación transcripcional independiente de ligando.
- C (DBD): región de unión al DNA altamente conservada, que contiene dos «dedos de zinc» que interactúan con los elementos de respuesta hormonal específicos (motivos HRE, en este caso denominado ERE), y de mediación de la dimerización del receptor.
- D: “región bisagra” de unión de los dominios C y E, que contiene una señal de localización nuclear y da flexibilidad al receptor.
- E/F (LBD + H12 / AF-2): dominio de unión al ligando, en posición C-terminal, y con función de activación transcripcional (AF-2) por unión a coactivadores en Helix 12 (H12). Importante para la regulación transcripcional dependiente de ligando.
Helix 12 es una región altamente conservada dentro de LBD. Cuando se une al ligando, su configuración estructural se modifica, resultando en una forma activa (unida al agonista) o inactiva (unida al antagonista) en la regulación de la transcripción.
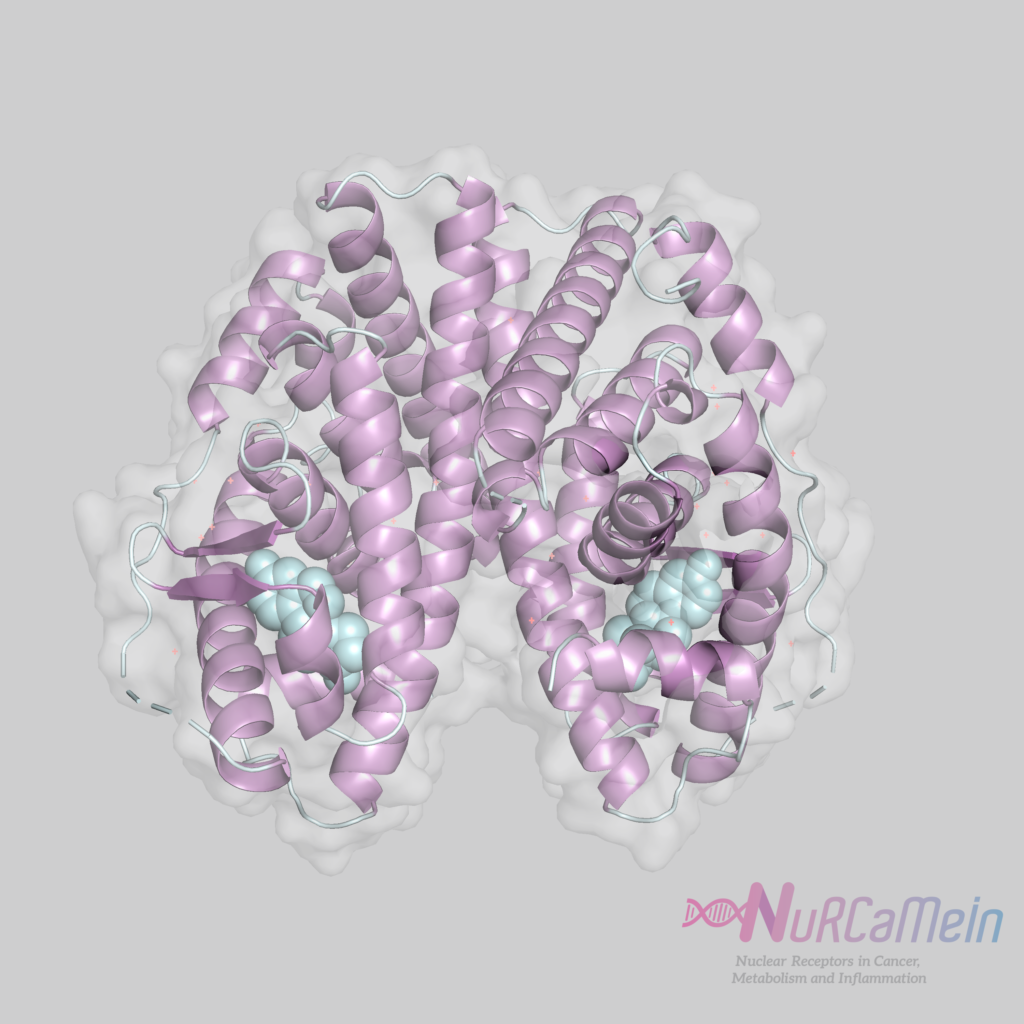
Estructura del ER
Tal como se ha descrito anteriormente, los ERs actúan de las siguientes formas:
- Mecanismo nuclear clásico: al unirse a los estrógenos, los ERs forman homo o heterodímeros que se unen al motivo ERE dentro del promotor de un gen diana, regulando así su transcripción.
- Mecanismo nuclear no clásico: los ERs pueden unirse de forma indirecta al motivo de DNA de AP-1 para regular, por ejemplo, la transcripción a través del dímero FOS / JUN (mecanismo de anclaje).
- Mecanismo iniciado fuera del núcleo: los ERs pueden asociarse a la membrana después de su palmitoilación, donde activan cascadas de señalización que pueden finalizar o no en la regulación de la transcripción.
- Mecanismo independiente de ligando: los factores de crecimiento (IGF, EGF) pueden fosforilar los ERs a través de las vías de señalización intracelular mediadas por el receptor de membrana del Factor de Crecimiento (GFR). Así los ERs pueden regular la expresión génica a pesar de la ausencia de ligando.
Expresión
Los ERαs se expresan mayoritariamente en la glándula mamaria y pituitaria, útero, ovarios (células tecales), huesos, órganos reproductores masculinos (testículos y epidídimo), próstata (estroma), hígado y tejido adiposo.
Mientras que los ERβs lo hacen principalmente en la próstata (epitelio), ovarios (células de la granulosa), pulmón, colon, tejido adiposo y sistema inmunitario.
Ambos subtipos de ER se expresan de forma notable en el sistema cardiovascular y sistema nervioso central.
Principales funciones
Los ERs regulan funciones fisiológicas clave en varios sistemas del organismo, como el sistema reproductivo (función y desarrollo de los ovarios), esquelético, cardiovascular y nervioso central; así como en tejidos específicos como del seno, próstata y ovario.
Los ERαs tienen un papel más destacado en la glándula mamaria y el útero, y en la preservación de la homeostasis esquelética y la regulación del metabolismo.
Los ERβs parecen tener una mayor actividad en el sistema nervioso central y el sistema inmune, y generalmente contrarresta la hiperproliferación celular promovida por los ERαs en tejidos como el seno y el útero.
Ambos receptores tienen funciones importantes en el metabolismo glucídico y lipídico, expresándose en adipocitos, músculo esquelético, hígado y páncreas endocrino.
Los ERs en la Red NuRCaMeIn
- Instituto de Investigación Desarrollo e Innovación en Biotecnología Sanitaria de Elche (IDiBE) | Universidad Miguel Hernández de Elche
- Receptores de estrógenos y diabetes | Nurcamein
- Cancer Heterogeneity Lab | CICbioGUNE
- Receptores nucleares y cáncer de mama | Nurcamein
Bibliografía
- Estrogen Receptors: New Directions in the New Millennium, Sylvia C. Hewitt et al. | Endocrine reviews
- Estrogen Hormone Biology, Katherine J. Hamilton et al. | Current Topics in Developmental Biology
- Estrogen, Estrogen Receptor and Lung Cancer, Li-Han Hsu et al. | International Journal of Molecular Sciences
