Una kinasa para gobernar a la diabetes: el papel de JNK
La Organización Mundial de la Salud (OMS) reconoció oficialmente a la obesidad como una enfermedad hace ya 70 años. Sin embargo, no fue hasta la última década del siglo XX que la población empezó a tomar conciencia de los problemas que el exceso de peso puede ocasionar a la salud. Hace ya una década que, basándose en datos a nivel mundial que indicaban que un 40% de la población adulta padecía sobrepeso y un 13% obesidad, la OMS declaró a la obesidad como una pandemia. Además, la obesidad es un factor de riesgo importante para otras muchas enfermedades, entre ellas la diabetes de tipo 2, cuyo incremento a nivel mundial ha sido paralelo al de la obesidad. Debido a este aumento tan desmesurado, tanto la obesidad como la diabetes tipo 2 representan retos muy importantes para los sistemas socio-sanitarios de los distintos países.
La diabetes es una enfermedad que se caracteriza por un nivel anormalmente elevado de glucosa en sangre (hiperglucemia o lo que comúnmente se conoce como tener azúcar en sangre). El principal regulador del nivel de glucosa en sangre (glucemia) es la insulina, hormona secretada por las células del páncreas cuando detectan una subida de dicho nivel (paso de normoglucemia a hiperglucemia). Una vez secretada, la insulina llega al resto de tejidos del cuerpo (tejidos como el músculo esquelético, el tejido adiposo o el hígado) y les indica que deben captar glucosa. Esta absorción devuelve al nivel de glucosa en sangre a la normalidad o normoglucemia.
En particular, la diabetes de tipo 2 se caracteriza por la falta de respuesta de los tejidos a la insulina, condición que se conoce como resistencia a la insulina. Por ejemplo, después de una comida aumenta la glucosa en sangre y el páncreas secreta insulina, pero como los tejidos laignoran debido a que son resistentes a la insulina, la glucosa no es absorbida y los niveles de azúcar en sangre continúan siendo elevados. En esta situación, la demanda de insulina sobre las células del páncreas persiste debido a la hiperglucemia. Con el paso del tiempo se produce un fallo pancreático, es decir, este órgano deja de producir insulina, instaurándose la diabetes de forma definitiva. En este sentido, la diabetes tipo 2 es de desarrollo lento ya que el paciente pasa por larga fase de resistencia a la insulina antes de que se produzca el fallo pancreático. A diferencia de la diabetes tipo 1 o insulino-dependiente, en la diabetes tipo 2 la administración de insulina no es muy eficiente dada la condición de resistencia a esta hormona. Por ello, los pacientes de diabetes tipo 2 también se tratan con otros tipos fármacos como las tiazolidinedionas (TZDs), agentes que alivian la resistencia a la insulina mediante su interacción con el receptor nuclear PPARγ.
El grupo de la Dra. Caelles estudia los mecanismos moleculares que se hallan alterados en la diabetes tipo 2 y en concreto, aquellos implicados en la resistencia a la insulina, en la que la proteína JNK tiene un papel muy relevante.
JNK es una proteína que se encuentra dentro de la célula y que participa en múltiples procesos, principalmente de tipo inflamatorio. En este sentido, la expansión del tejido adiposo que se produce durante la obesidad lleva asociado un proceso de inflamación crónica de baja intensidad en el que la actividad de JNK se encuentra anormalmente elevada. Este incremento en la actividad de JNK es una de las causas moleculares de la resistencia a la insulina. En consecuencia, la inhibición de la actividad de JNK esta asociada a una mejora de la respuesta a la insulina y representa una potencial alternativa terapéutica en el tratamiento de la diabetes tipo 2. En este contexto, el grupo de la Dra. Caelles demostró que las TZDs, a través de PPARγ, evitan la activación de JNK inducida por la obesidad y, como consecuencia de ello, aumentan la respuesta a la insulina. De este estudio se pudo concluir que la acción antidiabética de las TZDs se basa en este mecanismo molecular.
Debido a que el receptor de las TZDs, el PPARγ, se expresa de forma preferente en el tejido adiposo, se asumía que las TZDs actuaban principalmente sobre este tejido. En uno de sus últimos artículos, la Dra. Caelles decidió estudiar si las TZDs podían actuar directamente sobre las células secretoras de insulina del páncreas, dado que su receptor, aunque en menor medida, también se expresa en dichas células. Para llevar a cabo este estudio, desarrolló un modelo de ratón transgénico que además constituye un ejemplo de cómo la activación de una sola proteína en un tipo celular específico puede modificar la homeostasis del todo el organismo.
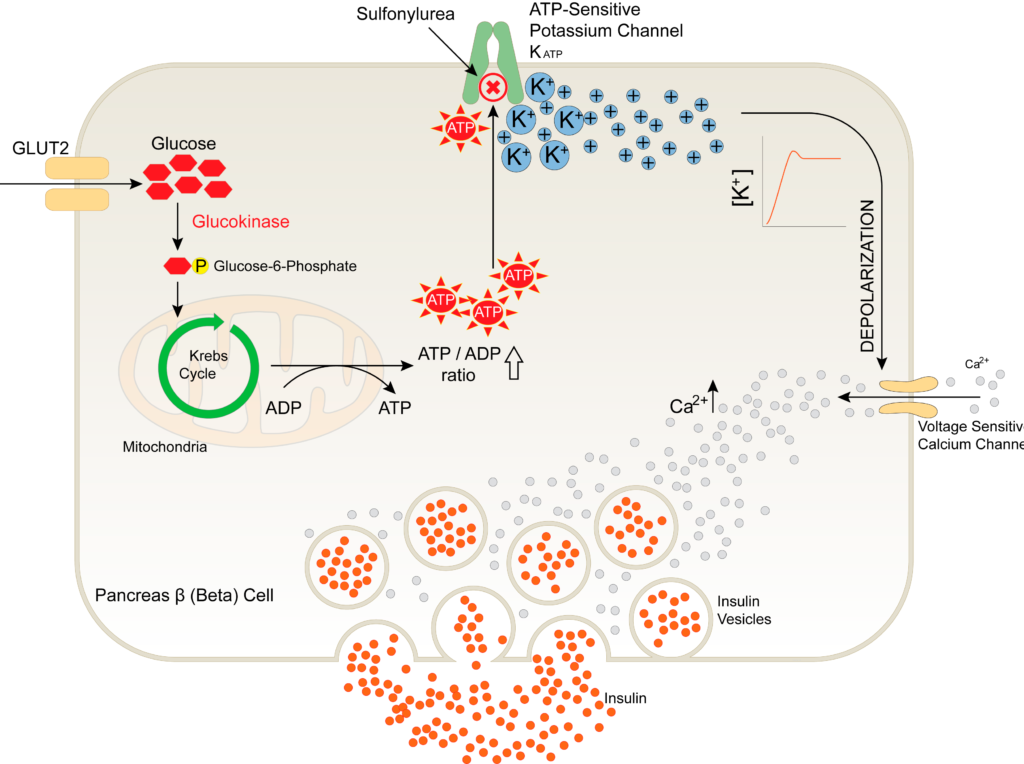
JNK necesita activarse para ejercer su papel. Dado que el grupo quería centrarse en el estudio del papel de la JNK en la resistencia a la insulina en células beta del páncreas, tenía que activarla específicamente en dichas células del ratón. Para ello, eligieron a MKK7, una proteína que activa a JNK, y concretamente, una versión mutante, MKK7D, cuya sola presencia en la célula mantiene a JNK activa permanentemente. Con el fin de lograr que MKK7D solo se expresara en las células del páncreas se diseñó un transgén de expresión en todas las células del organismo, con un promotor constitutivo que tenía bajo su control la secuencia del gen de MKK7D precedida por la secuencia de un gen que codifica para una proteína fluorescente verde (GFP, de Green Fluorescent Protein). El gen de la GFP estaba flanqueado por dos secuencias señal denominadas LoxP. En estas condiciones, se expresa el gen que queda en contacto con el promotor: en este caso, el gen de la GFP. Esta construcción se inyectó en ovocitos de ratón y se obtuvieron los ratones transgénicos.
Para conseguir que MKK7D se expresara y lo hiciera sólo en las células del páncreas, estos ratones se cruzaron con otros ratones también modificados genéticamente, siendo portadores de un transgén que codificaba para la proteína recombinasa Cre, que es capaz de cortar y pegar las señales LoxP (las que flanquean al gen de la GFP). En estos ratones la expresión del gen de la recombinasa Cre esta restringida a las células , por ello solo en estas se elimina el gen de la GFP y, concomitantemente, se induce la expresión del MKK7D, Finalmente, esto produce la activación permanente de JNK exclusivamente en estas células.
El estudio de estos ratones permitió concluir que, si bien la activación crónica de JNK no afecta a la morfología o la supervivencia de las células y tampoco influye sobre la cantidad de insulina que fabrican, sí que afecta negativamente a la secreción de insulina inducida por la hiperglucemia por parte de las células del páncreas. Debido a ello, los ratones muestran una intolerancia a la glucosa (situación en la que la glucemia permanece elevada durante más tiempo del normal) que es aliviada con el tratamiento con TZDs. Además de demostrar el papel de JNK en la regulación de la secreción de la insulina en respuesta a glucosa, este trabajo fue pionero en mostrar que estos fármacos también actúan a nivel de células pancreáticas.
Los ratones transgénicos generados en este estudio servirán para continuar estudiando las vías moleculares de las células pancreáticas y representan una herramienta de trabajo para el estudio de la diabetes, una enfermedad que afecta a 1 de cada 11 personas y que es responsable de la muerte de un millón y medio de personas al año.
*Imagen de portada: Islote de Langerhans aislado de páncreas de rata. Los núcleos se muestran de color azul, mientras que las células beta están teñidas de color verde (insulina) y las células alfa de color rojo (Wikimedia Commons) *El artículo completo en inglés está disponible en Mapping Ignorance.
