Osteoporosis, menopausia y RXR
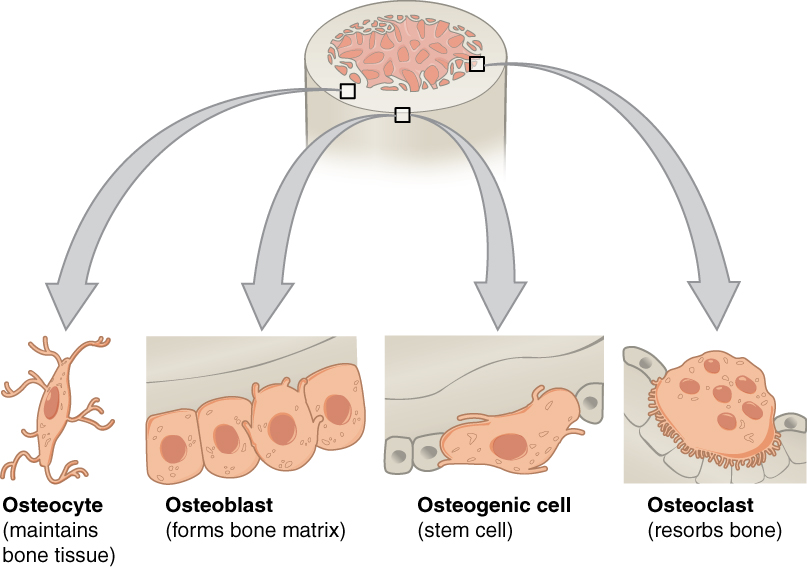
Como el río de Heráclito, nuestros huesos cambian constantemente. Aunque no lo parezca, este tejido se forma y destruye de una forma dinámica, lo que hace que el sistema óseo sea diferente a lo largo de las distintas etapas de la vida. La destrucción o reabsorción del hueso está mediada por un tipo celular denominado osteoclasto (osteo, hueso; clasto, romper). Los osteoclastos derivan de células precursoras hematopoyéticas, o lo que es lo mismo, aquellas que dan lugar a las células que circulan por la sangre, de ahí que su nombre derive de la unión de hemato (sangre) y poiesis (hacer).
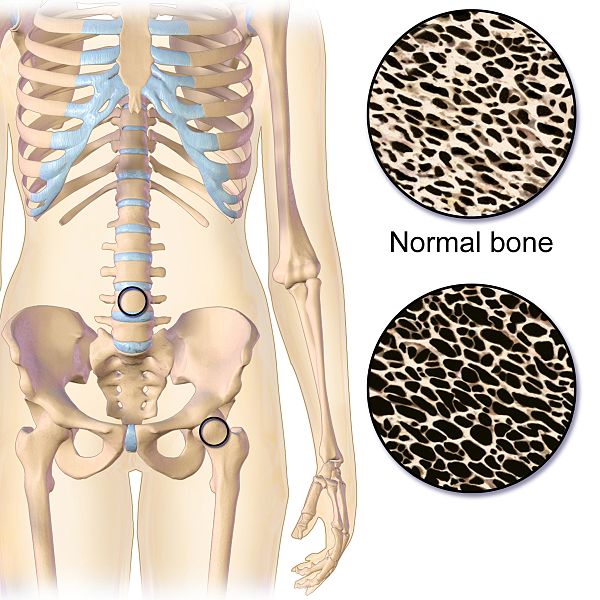
Tanto la cantidad de osteoclastos como el control de su actividad son fundamentales para mantener un hueso sano. De hecho, si se desregula alguno de estos dos factores el equilibrio entre la formación y destrucción del hueso se rompe, creando importantes alteraciones como la osteoporosis. En esta patología se produce un aumento de osteoclastos, resultando en una mayor tasa de destrucción ósea. Aunque la osteoporosis está íntimamente relacionada con cambios hormonales naturales, como los que ocurren durante la menopausia, también la provocan condiciones patológicas, como es el caso de la resistencia a la insulina. Actualmente, los tratamientos disponibles para hacer frente a la osteoporosis tienen numerosos efectos secundarios. Por ello, estudiar los mecanismos moleculares que influyen en el equilibrio óseo y en concreto, en el control del número y actividad de los osteoclastos permitiría identificar nuevos tratamientos que sean más eficaces y menos perjudiciales.
El receptor X de retinoides (RXR) es un receptor nuclear que controla la expresión de numerosos genes en las células. Uno de estos grupos de genes regulados por RXR tiene un papel fundamental en el control del metabolismo de la glucosa. Debido a que la resistencia a la insulina es un factor de riesgo para desarrollar osteoporosis y que está directamente vinculada a la homeostasis de la glucosa, el grupo de la Dra. Ricote se propuso investigar el papel de RXR en la homeostasis del hueso. Pero… ¿cómo? Para ello, generaron ratones con células hematopoyéticas (y por tanto, osteoclastos) carentes de RXR.
Estos ratones se obtuvieron tras cruzar ratones cuyos genes RXR se encontraban flanqueados por secuencias LoxP con ratones con el gen para la recombinasa Cre controlada por un promotor determinado que es activado en presencia de una sustancia denominada pI:pC. Quizás resulte algo confuso, vayamos por partes…La enzima Cre reconoce las secuencias LoxP y corta lo que haya entre ellas. Si hay Cre, desaparece el gen flanqueado por LoxP; si no hay Cre, el gen se expresa de manera normal. En estos experimentos, Cre se activa únicamente cuando los ratones son inyectados con pI:pC. Así, los ratones se desarrollan de manera normal y tras el nacimiento se les inyecta pI:pC, lo que conlleva la activación de Cre en las células hematopoyéticas. Entonces Cre elimina las secuencias flanqueadas por LoxP y las células hematopoyéticas, incluyendo los precursores de osteoclastos, pierden la expresión de RXR.
Y la siguiente pregunta que cabe esperar es… ¿Y qué ocurrió con los ratones con osteoclastos sin RXR? La primera diferencia se observó en el grosor de los huesos de los machos, pues los ratones mutantes tenían unos huesos más densos. Sin embargo, este resultado no se repitió en las hembras. Tras estudiar el hueso a nivel microscópico, se confirmó que los osteoclastos sin RXR eran más grandes y no estaban tan adheridos al hueso, lo que disminuía su actividad y hacía que no lo destruyeran de igual forma que en los animales control. Los autores concluyeron que RXR tenía un papel en la tasa de creación/destrucción ósea, al menos en machos.
¿Y las hembras? ¿La ausencia de RXR no tenía ninguna repercusión fisiológica? No, al menos en hembras sanas. Sin embargo, teniendo en cuenta los cambios hormonales que ocurren durante la menopausia, el grupo de la Dra. Ricote extrapoló el estudio a un modelo de ratonas a las cuales se le habían extraído los ovarios. Dicha eliminación conlleva una deficiencia en estrógenos que induce un cuadro similar al que ocurre en la menopausia. En animales no modificados, esta operación conllevó un aumento en la actividad de los osteoclastos (y por tanto, osteoporosis), lo que no ocurrió en los osteoclastos carentes de RXR. Es decir, en un modelo de ratón menopáusico, RXR promueve la osteoporosis puesto que cuando no está presente, la activación de osteoclastos y degradación de hueso es menor.
Se realizaron también estudios con cultivos celulares. En el laboratorio se pueden diferenciar osteoclastos a partir de células hematopoyéticas de médula ósea tratadas con diferentes proteínas. Estas proteínas inducen la proliferación y posterior fusión de las células hematopoyéticas, dando lugar a células grandes y multinucleadas: los osteoclastos. De manera coherente con los resultados anteriores, los osteoclastos sin RXR eran mayores que los osteoclastos con expresión normal de RXR. El grupo determinó que la formación de estos osteoclastos anormalmente grandes se debía a un aumento en la tasa de proliferación de las células hematopoyéticas progenitoras de osteoclastos. Al ser mayores, se podría esperar que estos osteoclastos reabsorbieran más huesos. Sin embargo se observaba el efecto opuesto: a pesar de su mayor tamaño, su actividad era menor.
Para determinar qué mecanismos moleculares se hallaban detrás de estas diferencias, el grupo estudió la expresión de diferentes genes que se inducen con el tratamiento para obtener osteoclastos. Uno de estos genes cuya expresión estaba muy reducida en células sin RXR era MAFB. Por tanto, era un candidato perfecto para explicar los cambios observados en la diferenciación osteoclástica en ratones deficientes en RXR.
Esquemáticamente podríamos decir que:
+RXR → + MAFB → proliferación normal → osteoclastos normales
no RXR → no MAFB → proliferación anormal → osteoclastos alterados
Para validar la acción de MAFB en la diferenciación de osteoclastos, se infectaron células hematopoyéticas progenitoras de osteoclastos con lentivirus modificados que daban lugar a una expresión aumentada de MAFB. Los resultaron mostraron cómo las células sin RXR pero con MAFB exógeno tenían una tasa de proliferación como la de células normales. En conclusión, si los progenitores de osteoclastos no tienen RXR no pueden expresar MAFB y no proliferan correctamente. Sin embargo, si añades MAFB independientemente de RXR, recuperan una tasa de proliferación normal. Por tanto, RXR se demuestra como un controlador esencial en la diferenciación de los osteoclastos.
no RXR → no MAFB → proliferación anormal → osteoclastos alterados
no RXR + MAFB (lentivirus) → proliferación normal → osteoclastos normales
Pero… ¿qué ocurre con aquellos osteoclastos con RXR si dejan de tener MAFB? A través de técnicas que contemplan el uso de RNA de interferencia, pequeño RNA que silencia la expresión de un gen de interés, se comprobó que dichas células aumentaban su tamaño y disminuían su actividad.
+RXR → + MAFB → osteoclastos normales
+RXR no MAFB (RNAi) → osteoclastos alterados
Para comprobar que MAFB era un gen controlado directamente por RXR se realizaron estudios con diferentes moléculas capaces de activar a RXR. Todas ellas inducían MAFB siempre que RXR estuviera presente en la célula. Paradójicamente, los autores demostraron que si en mitad del proceso de diferenciación de osteoclastos se inducía la expresión de MAFB con moléculas que activan RXR, se producía un bloqueo total de la diferenciación. Es decir, tanto la ausencia de RXR en el inicio de la diferenciación osteoclástica como su posterior activación cuando el proceso de diferenciación ha comenzado tenían el mismo efecto: una disminución de la actividad osteoclástica.
¿Estos resultados podrían tener alguna aplicación terapéutica? Para contestar a esta pregunta se trataron ratones con un fármaco que activa RXR denominado Bexaroteno, el cual es actualmente empleado para el tratamiento de linfomas cutáneos. El Bexaroteno no tuvo ningún efecto en la densidad del hueso de ratones normales. Sin embargo, cuando se suministró a ratonas a las que se habían extraído los ovarios (modelo de menopausia), se observó una clara mejoría, pues estos animales presentaron un hueso menos desgastado y una menor actividad osteoclástica que las ratonas sin tratar.
En conjunto, estos resultados indican que el uso de moléculas que modulen la actividad de RXR podría servir para tratar enfermedades de los huesos que afectan a la masa ósea. Dado que el bexaroteno presenta algunos efectos secundarios, sería deseable desarrollar nuevos fármacos con capacidad de modular RXR evitando dichos efectos secundarios.