La estructura importa en el receptor de andrógenos
El estudio de los receptores nucleares incluye una gran diversidad de artículos y técnicas: desde experimentos con ratones transgénicos para comprobar su efecto en el organismo hasta estudios de estructura tridimensional a nivel atómico en los que se indaga la posición de cada aminoácido y su función. El trabajo del laboratorio de la doctora Estébanez se centra en este último aspecto. En su artículo de 2017, el grupo estudió la estructura tridimensional del receptor de los andrógenos.
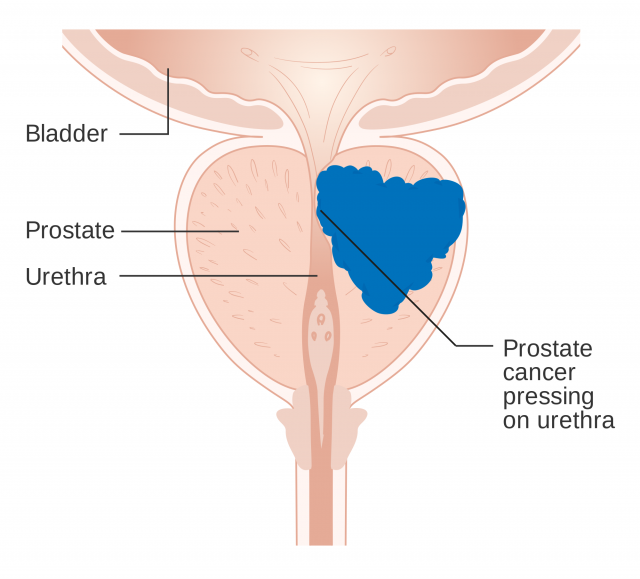
Este receptor es esencial para la fisiología, el desarrollo y el metabolismo tanto de hombres como de mujeres, ya que los andrógenos son conocidos popularmente como hormonas sexuales masculinas. Algunas enfermedades (principalmente masculinas, eso sí) se relacionan con mutaciones de este receptor. Así, los pacientes con cáncer de próstata o con síndrome de insensibilidad a los andrógenos presentan cambios en la secuencia de aminoácidos de sus receptores de andrógenos.
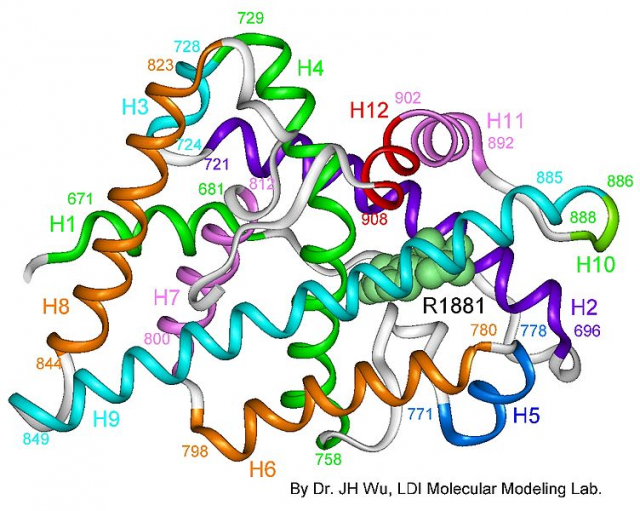
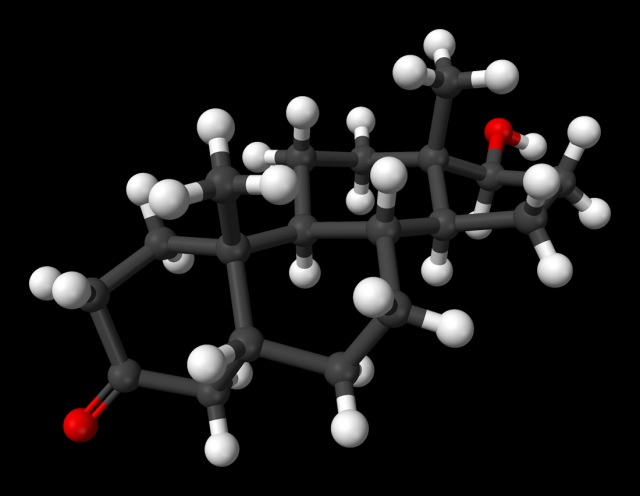
El estudio de la estructura 3D del receptor permite comprender mejor su función (y, por extensión, la de todos los receptores nucleares). Además, permite relacionar diferentes mutaciones con su efecto sobre la función del receptor. Por todo ello, constituye un paso esencial tanto para la comprensión de las enfermedades basadas en sus mutaciones como para el desarrollo de fármacos que puedan alterar específicamente algunas funciones del receptor sin afectar al resto. El grupo de la doctora Estébanez estudió en concreto la estructura del dominio LBD del receptor unido a su ligando natural (la dihidrotestosterona) y a un péptido coactivador.
Este complejo fue cristalizado y analizado por difracción de rayos X en el sincrotrón ALBA del campus de la Universitat Autònoma de Barcelona. Su análisis les permitió dilucidar la estructura tridimensional con una resolución media de 2,15 Å (0,215 nm o 2,15 · 10-10 m). Para hacernos una idea, la distancia entre el átomo de oxígeno y uno de los átomos de hidrógeno de la molécula del agua es de un poco menos de 1 Å. Utilizando una analogía, sería como ser capaces de ver la pantalla de un Smartphone de 7 pulgadas si nuestro cuerpo tuviera un tamaño de un millón de kilómetros (superior al de la órbita de la Luna). Un magnífico ejemplo de precisión infinitesimal.

Esta definición permite ver dónde se sitúa cada átomo de la cadena de aminoácidos plegada del receptor. Recordemos que el plegamiento tridimensional es el que dota de funciones a las proteínas. Las mutaciones puntuales presentan cambios de un aminoácido por otro. Estos cambios pueden producir variaciones en el plegamiento de la proteína y, por tanto, en su función. El estudio permitió identificar una estructura concreta de 1.000 Å cuadrados que sería la responsable de la dimerización del receptor. Diferentes mutaciones asociadas con cáncer de próstata o con el síndrome de insensibilidad a andrógenos se situaban en esta región. Se puede inferir, por tanto, que estas mutaciones alteran el LBD y, por tanto, afectan la dimerización y la función del receptor de andrógenos.
Para simular los efectos sobre la estructura de las diferentes mutaciones, se utilizaron programas informáticos que permitieron comprobar que, efectivamente, muchas de ellas alteraban el plegamiento de esta región. La mayoría impiden que los receptores dimericen; una de ellas (la Y764C), sin embargo, estabilizaba las parejas de receptores. Para comprobar experimentalmente estas simulaciones, se escogieron algunas de estas mutaciones y se comprobó su efecto en células mediante dos técnicas distintas.
En una de ellas se comprobó el efecto de cada mutación sobre la acción transcripcional del receptor. Para ello, se introdujo en las células el gen de la luciferasa precedido de un promotor con elementos de respuesta a andrógenos. El receptor de los andrógenos se une a estos elementos y estimula la producción del gen con el que están asociados, en este caso un gen fluorescente. La medida de la fluorescencia se relaciona con la capacidad de promover la transcripción del receptor (mayor fluorescencia, mayor transcripción). Se introdujeron en células receptores mutados para cada una de las mutaciones identificadas. La mayoría de las mutaciones presentaban una disminución o pérdida de la capacidad transcripcional (la fluorescencia disminuía o desparecía). La Y764C, que produce dímeros más estables, presentaba una mayor actividad transcripcional (mayor fluorescencia) que la versión no mutada del receptor.
La otra técnica permite estudiar la dimerización de proteínas. Esta técnica, conocida como acceptor photobleaching FRET, permite estudiar la interacción entre proteínas utilizando un microscopio de fluorescencia. Los microscopios de fluorescencia ofrecen una resolución de un centenar de nanómetros (se pueden distinguir los orgánulos más grandes). La interacción entre proteínas se da a nivel nanométrico… ¿cómo conseguir este incremento de resolución de más de 100 aumentos?
La técnica FRET se basa en el uso de dos moléculas fluorescentes. Cada molécula fluorescente es capaz de absorber luz de una longitud de onda concreta y emitir luz de otra longitud de onda determinada. Para simplificar, podemos decir que absorben un color y emiten otro color. Pues bien, en la técnica del FRET se combinan dos moléculas fluorescentes (A y B). Las células se estimulan con un láser del color que absorbe A; esta molécula brilla en verde. B absorbe precisamente el color verde y brilla en rojo. El brillo de B depende directamente de la distancia que le separa de A. Contra más cerca (y estamos hablando de distancias muy, muy cercanas), más rojo emite. Si A y B están separadas, sólo se detecta verde (sólo A brilla). Si A y B están pegadas, brillan las dos y se detecta tanto verde como rojo. Una solución muy elegante (y vistosa) para comprobar cuán cerca se encuentran dos proteínas y, por tanto, aumentar la resolución de un microscopio fluorescente hasta la escala nanométrica.
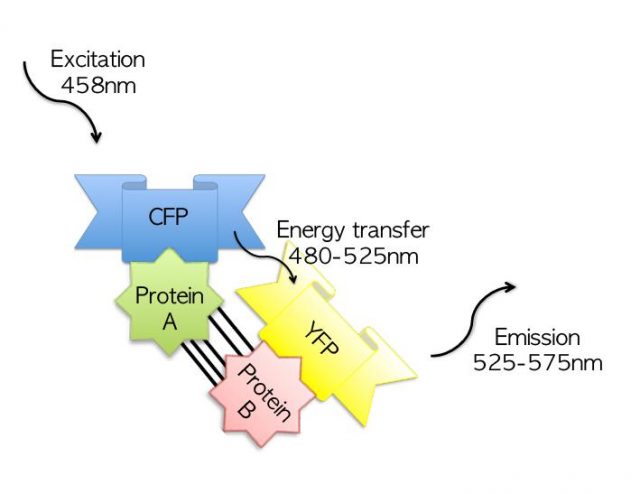
El laboratorio de la doctora Estébanez elaboró un constructo formado por el LBD del receptor unido a la molécula fluorescente A y otro con el LBD del receptor unido a la molécula B. Mutaron los LBDs y comprobaron experimentalmente el efecto de cada mutación sobre la dimerización. Los resultados encajaban con las predicciones y con los experimentos de control de la transcripción. En definitiva, estamos ante un artículo espectacular que permite estudiar la estructura a nivel atómico y las interacciones entre proteínas y que constituye un hito en el estudio del mecanismo de dimerización de los receptores nucleares.
*Imagen de portada: Estructura cristalina del receptor de andrógenos humano (Wikimedia Commons). *El artículo completo en inglés está disponible en Mapping Ignorance.
